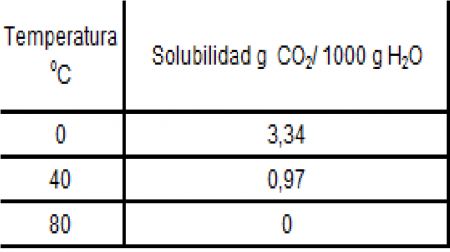
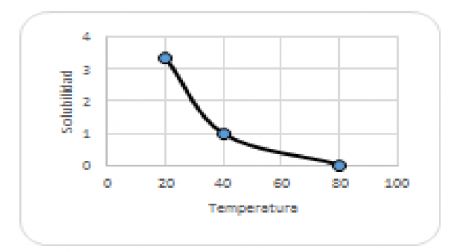
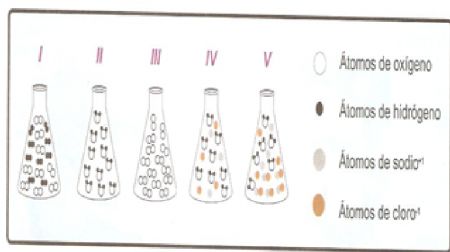
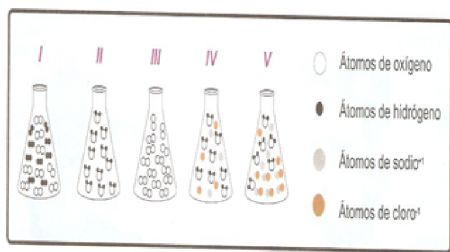
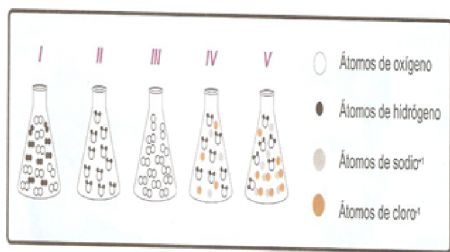
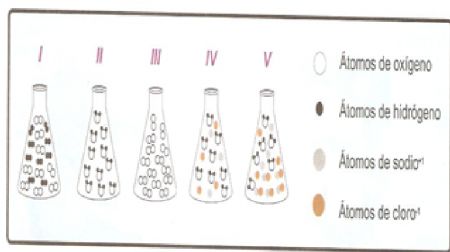
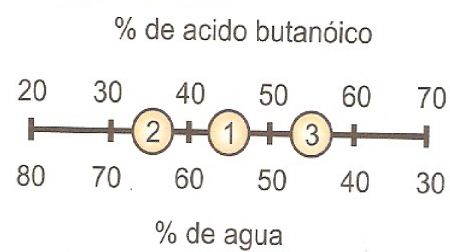
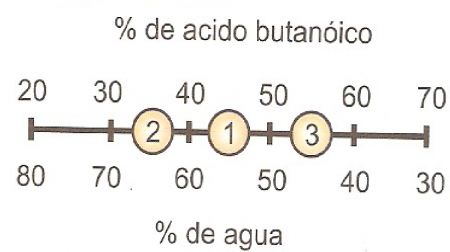
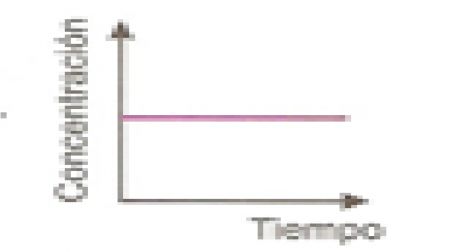
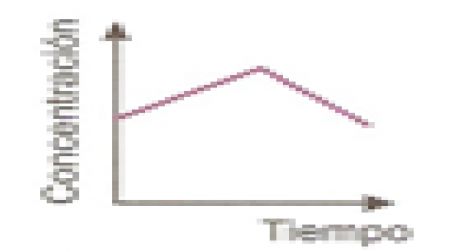
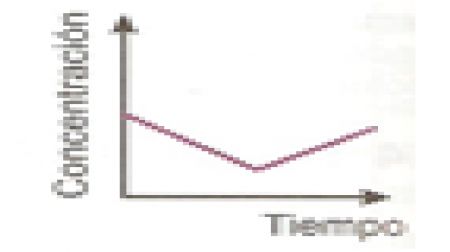
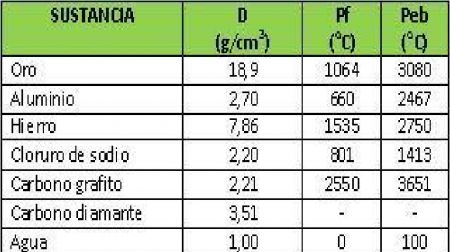
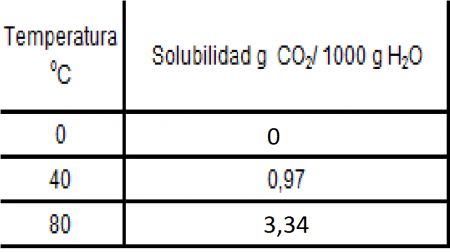
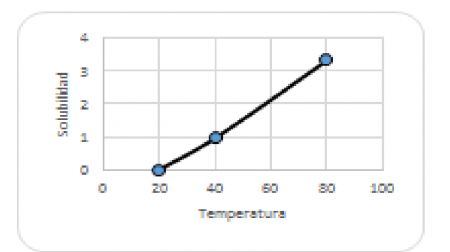
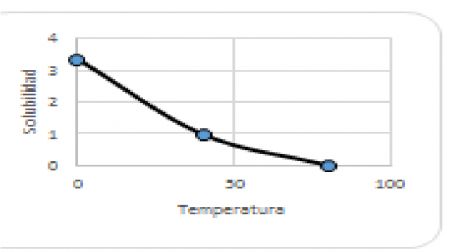
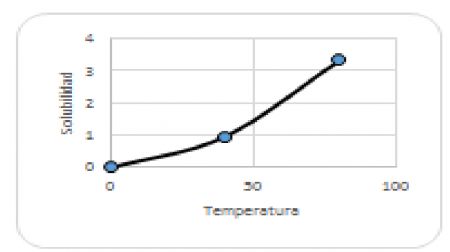
25.
Sabemos que existen diferentes métodos de separación de mezclas, basados en propiedades físicas de la materia, Por ejemplo la destilación se basa en los puntos de ebullición de los componentes de la mezcla, La decantaciòn en _____________, la imantaciòn en _____________, la filtraciòn en ________________ y el tamizaje en _________________.