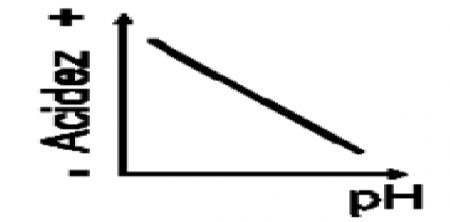
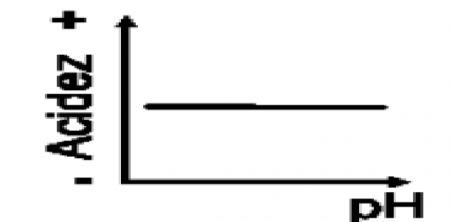
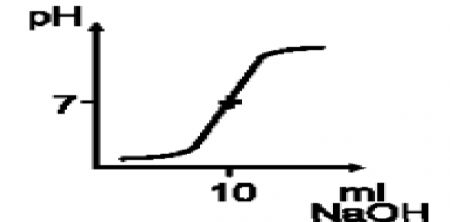
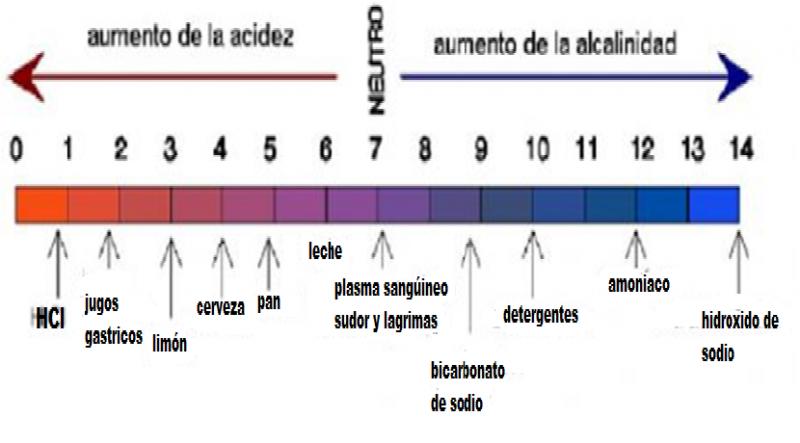
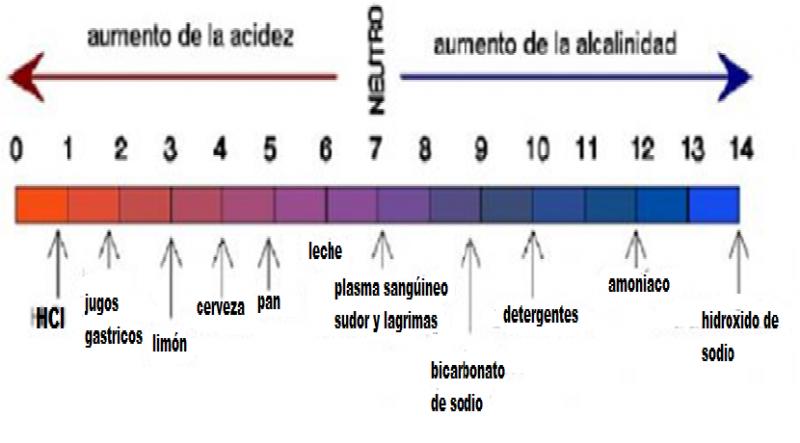
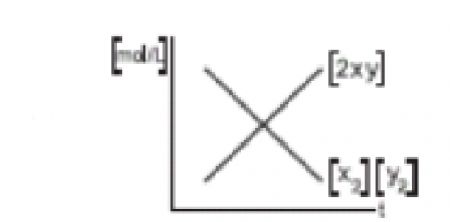
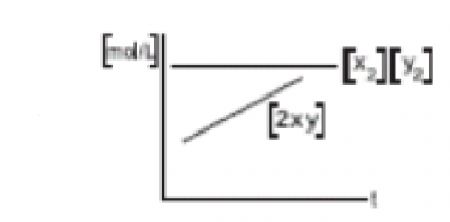
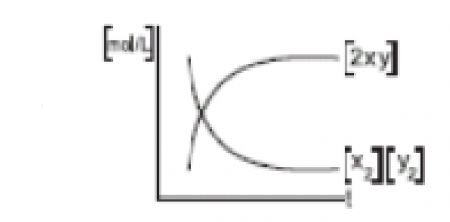
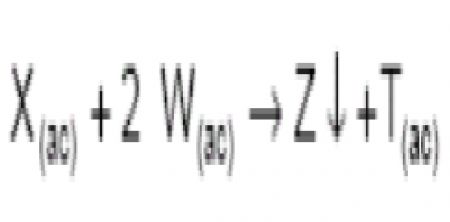
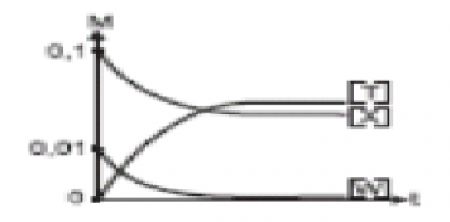
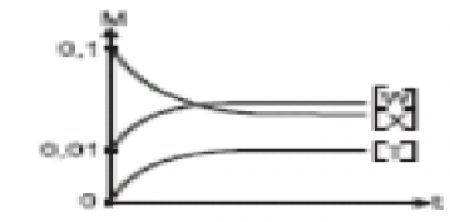
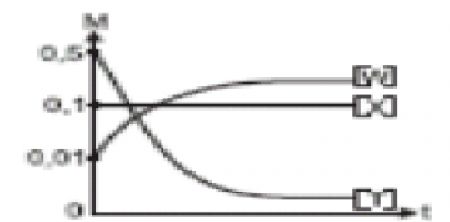
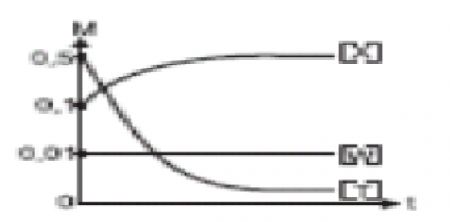
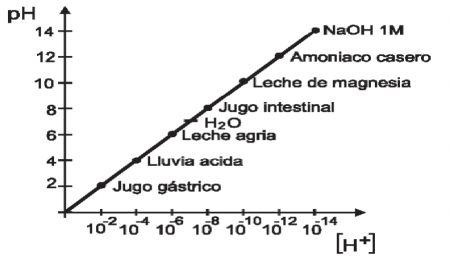
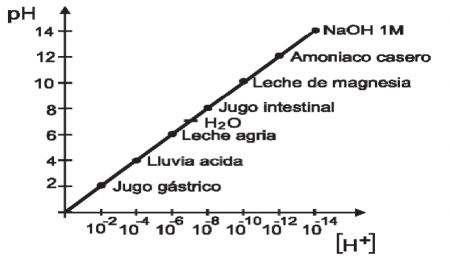
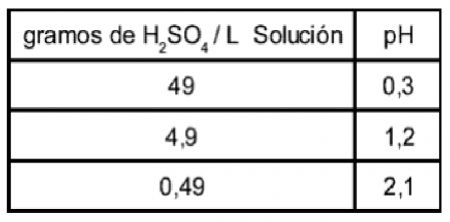
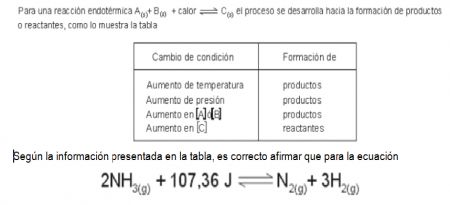
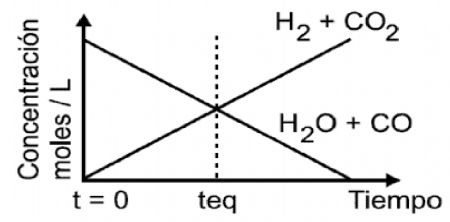
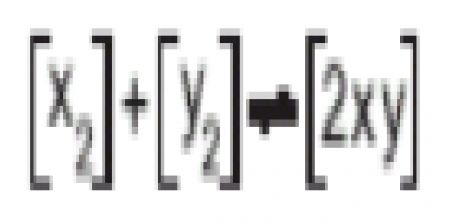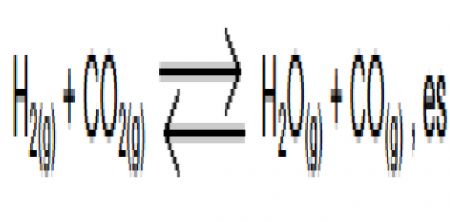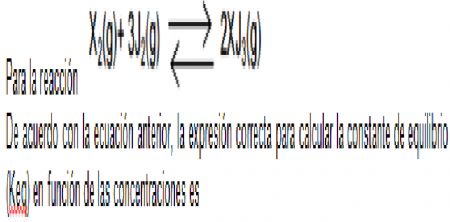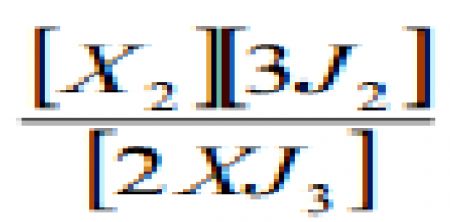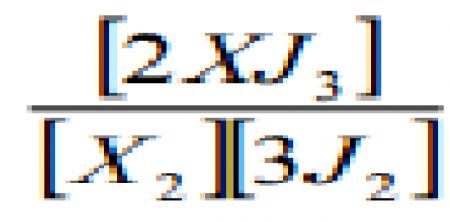1.

El ácido reacciona con los metales, observándose desprendimiento de burbujas (de hidrógeno) mientras disminuye la cantidad de metal a través del tiempo, a diferente velocidad en cada tubo. De las observaciones, se establece que el orden de velocidad de reacción del ácido con los metales de mayor a menor es: Mg, Zn, Fe y Cu. De lo anterior, es correcto afirmar que el factor que afecta la velocidad de reacción en el experimento es la